Geschwindigkeit chemischer Reaktionen
1. Definition
Die Reaktionsgeschwindigkeit ist ein Maß für die Zunahme der Konzentration eines Produkts pro Zeiteinheit bzw. Abnahme eines Edukts pro Zeiteinheit bei einer chemischen Reaktion.
RG = -∆CEdukt /∆t = -∆CProdukt /∆t
(∆C = Konzentrationsänderung)
Da die Konzentration des Edukts abnimmt, steht vor dessen Quotienten ein negatives Vorzeichen, damit das Ergebnis der Geschwindigkeit positiv wird.
Einheit der Reaktionsgeschwindigkeit: [mol/(l*min)]
2. Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit
Für die Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit gilt folgende Formel:
RG = k * CAn * CBm
Für die Reaktion: A + B -> C + D
n+m...Reaktionsordnung(Summe aus n+m)
k...Geschwindigkeitskonstante
C...Konzentration des Edukts A bzw. B [mol/l]
3. Temperaturabhängigkeit der Reaktionsgeschwindigkeit
Im Bereich nahe der Raumtemperatur ist die Reaktionsgeschwindigkeit sehr stark von der Temperatur abhängig.
Beispielsweise hat eine Temperaturerhöhung von 10 Grad Celsius eine Erhöhung der Reaktionsgeschwindigkeit um das ca. 2- bis 4-fache zur Folge.
Ursache der erhöhten Reaktionsgeschwindigkeit ist die größere kinetische Energie der Atome/Molekühle.(Näheres hierzu im Punkt Kollisionstheorie)
4. Kollisionstheorie
Grundlage: Atome/Molekühle müssen zusammenstoßen um zu reagieren. Es führt jedoch nur ein Bruchteil aller Kollisionen zu Reaktionen der Teilchen. Solche Kollisionen werden auch als effektive Kollisionen bezeichnet.
Ist eine Kollision nicht heftig genug (zu geringe kinetische Energie) oder erfolgt sie unter ungünstigem Winkel, so ist sie nicht effektiv.
Aus dieser Grundlage heraus kann folgender Schluß gezogen werden:
Je häufiger Teilchen zusammenstoßen, desto größer ist die Anzahl der effektiven Kollisionen und somit ist auch die Reaktionsgeschwindigkeit umso höher.
Es gilt: Reaktionsgeschwindigkeit proporional zur Zahl der Kollisionen pro Zeiteinheit
Eine solche effektive Kollision bei einer exothermen Reaktion soll nun an Hand des nachfolgenden Beispiels näher erläutert werden:
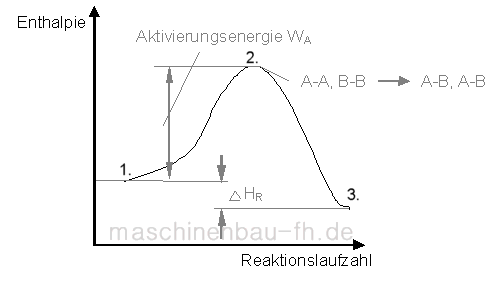
A2 + B2 -> 2 AB
zwischen 1. und 2.: Aktivierungsenergie wird für Auflösung der Bindungen zwischen A-A und B-B benötigt
in 2.: Kräftegleichgewicht zwischen den Molekühlen (A-A und B-B brechen in A-B auf; effektive Kollision), Zustand wird auch als aktiver Komplex bezeichnet
zwischen 2. und 3.: Bindungen zwischen A-B verstärken sich
Bei der exothermen Reaktion wird die Aktivierungsenergie in der Phase zwischen 2. und 3. wieder vollständig zurück gewonnen.
Für eine endotherme Reaktion kann man sich den Reaktionsverlauf in umgekehrter Reihenfolge vorstellen. Hierbei wird die Aktivierungsenergie nicht vollständig zurück gewonnen.
5. Einfluss eines Katalysator
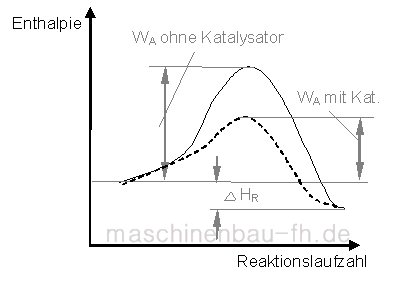
Katalysatoren setzen die Aktivierungsenergie herab.
Dies lässt sich durch die Bildung von Zwischenbindungen erklären. Der Katalysator ermöglicht also einen neuen Reaktionsablauf, der insgesamt eine niedrigere Aktivierungsenergie benötigt. Aus der niedrigeren Aktivierungsenergie folgt eine höhere Reaktionsgeschwindigkeit.
Beispiel:
A + B -> AB
(Reaktion ohne Katalysator)
A + Kat -> A-Kat
A-Kat + B -> AB + Kat
(Reaktion mit Katalysator)
Beachte: Der Katalysator wird nicht verbraucht. Es genügen daher schon kleine Mengen.

