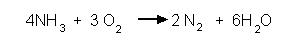Redoxreaktion
Bei einer Redoxreaktion findet eine Oxidation, d.h. eine Elektronenabgabe und eine Reduktion (Elektronenaufnahme) statt. Darüber hinaus spricht man bei Stoffen die leicht Elektronen aufnehmen von Oxidationsmitteln, wohingegen Stoffe, die leicht Elektronen abgeben als Reduktionsmittel bezeichnet werden.
Um die Reaktionsgleichung einer Redoxreaktion aufzustellen, wird folgendermaßen vorgegangen:
- Produkte und Edukte werden niedergeschrieben und die Oxidationszahlen ermittelt
- Das Verhältnis von Oxidationsmittel und Reduktionsmittel wird durch das Ausgleichen von Oxidationszahlzunahme bzw. -abnahme ermittelt
- Wenn nötig wird die Summe der Ionenladungen ausgeglichen. In wässrigen Lösungen geschieht dies mit Hilfe von H+/H3O+ und OH-
Zur Ermittlung der Oxidationszahlen gilt es folgende Grundregeln zu beachten:
- Elemente haben stets die Oxidationszahl 0
- Fluor in einer Verbindung hat immer die Oxidationszahl -1
- Wasserstoff in einer Verbindung hat meist die Oxidationszahl +1
- Sauerstoff in einer Verbindung hat meist die Oxidationszahl -2
(Ausnahme z.B. H2O2; H:+1, O:-1)
- Metalle in einer Verbindung haben immer positive Oxidationszahlen
- Die Oxidationszahlsumme der Elemente einer Verbindung ist 0
- Bei einem Ion ist die Summe der Oxidationszahlen der Elemente einer Verbindung gleich der Ionenladung.
Beispiel:
1. Niederschreiben der Produkte und Edukte und ihrer Oxidationszahlen
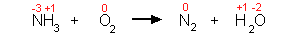
2. Aufstellen und Ausgleichen der Oxidationsgleichung
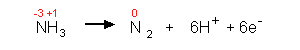
3. Aufstellen und Ausgleichen der Reduktionsgleichung
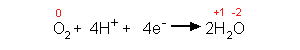
4. Erweitern der Oxidationsgleichung (mal 2) und Reduktionslgeichung(mal 3) auf das kleinste gemeinsame Vielfache der Elektronenzahl (hier 12) ergibt die abschließende Reaktionsgleichung.